欢迎访问杭州山友医疗器械有限公司网站!
18969937099
国家药监局关于调整《医疗器械分类目录》部分内容的公告(2020年 第147号)
为进一步深化医疗器械审评审批制度改革,依据医疗器械产业发展和监管工作实际,按照《医疗器械监督管理条例》有关要求,国.家药监局决定对《医疗器械分类目录》部分内容进行调整。现将有关事项公告如下:
一、调整内容
对28类医疗器械的《医疗器械分类目录》内容进行调整,其中,15类医疗器械管理类别进行调整(见附件1),13类医疗器械目录内容进行调整(见附件2)。
二、实施要求
(一)自本公告发布之日起,药品监督管理部门依据《医疗器械注册管理办法》《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》《关于第.一类医疗器械备案有关事项的公告》等,按照调整后的类别受理医疗器械注册和备案申请。
(二)对于已受理尚未完成注册审批(包括首.次注册和延续注册)的医疗器械,药品监督管理部门继续按照原受理类别审评审批,准予注册的,核发医疗器械注册证,并在注册证备注栏注明调整后的产品管理类别。
(三)对于已注册的医疗器械,其管理类别由第三类调整为第二类的,医疗器械注册证在有效期内继续有效。如需延续的,注册人应当在医疗器械注册证有效期届满6个月前,按照改变后的类别向相应药品监督管理部门申请延续注册,准予延续注册的,按照调整后的产品管理类别核发医疗器械注册证。
对于已注册的医疗器械,其管理类别由第二类调整为第.一类的,医疗器械注册证在有效期内继续有效。注册证到期前,注册人可向相应药品监督管理部门申请产品备案,备案资料符合要求的,药品监督管理部门应当按照相关要求制作备案凭证,并在其网站公布备案信息表中登载的信息。
(四)医疗器械注册证有效期内发生注册变更的,注册人应当向原注册部门申请注册变更。如原注册证为按照原《医疗器械分类目录》核发,本公告涉及产品的注册变更文件备注栏中应当注明公告实施后的产品管理类别。
(五)各级药品监督管理部门要加强《医疗器械分类目录》内容调整的宣贯培训,切实做好相关产品审评审批、备案和上市后监管工作。
本公告自发布之日起实施。
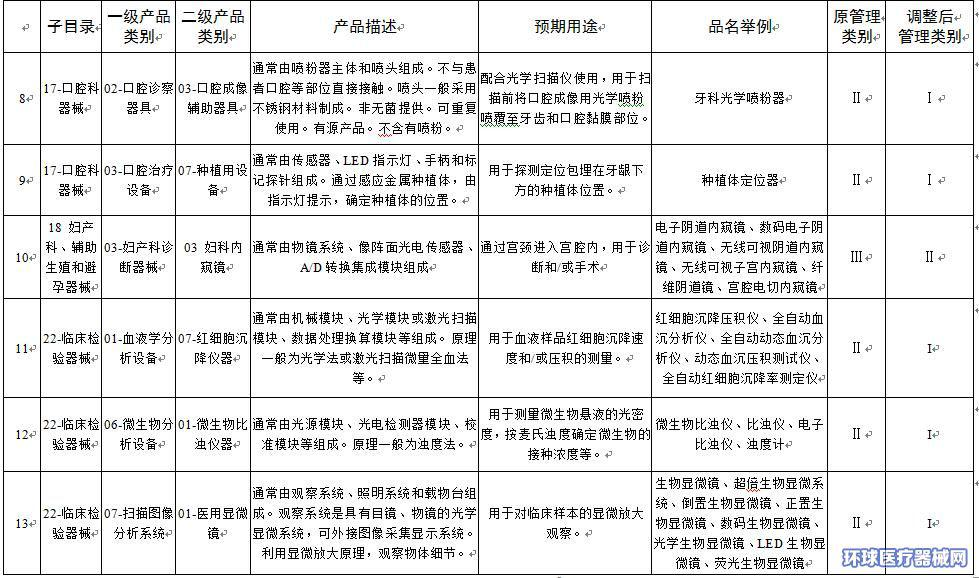
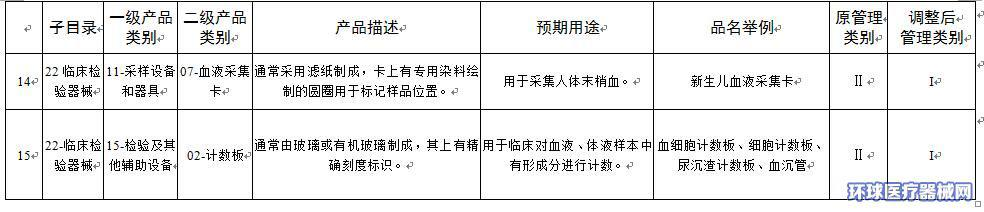
附件:1.医疗器械分类目录产品管理类别调整意见汇总表
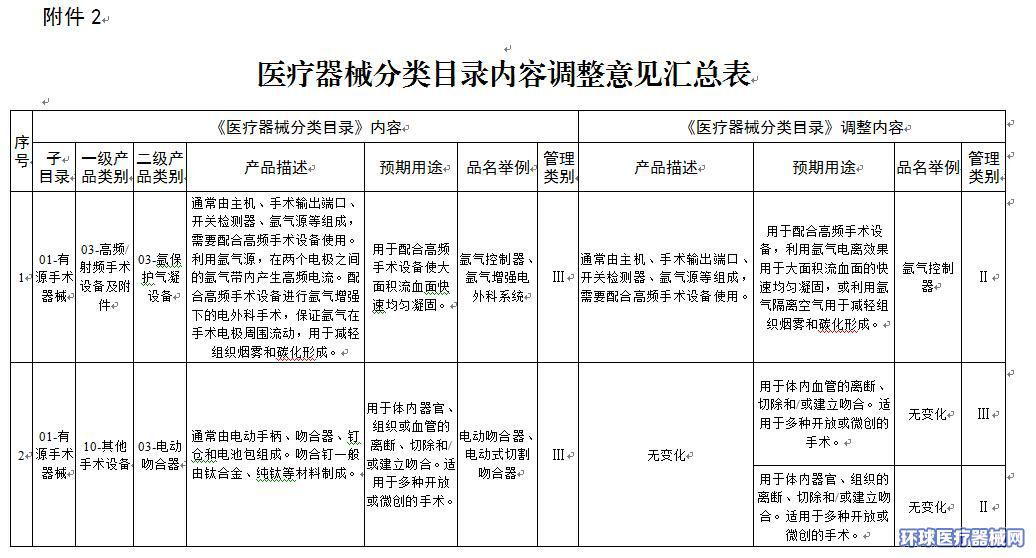
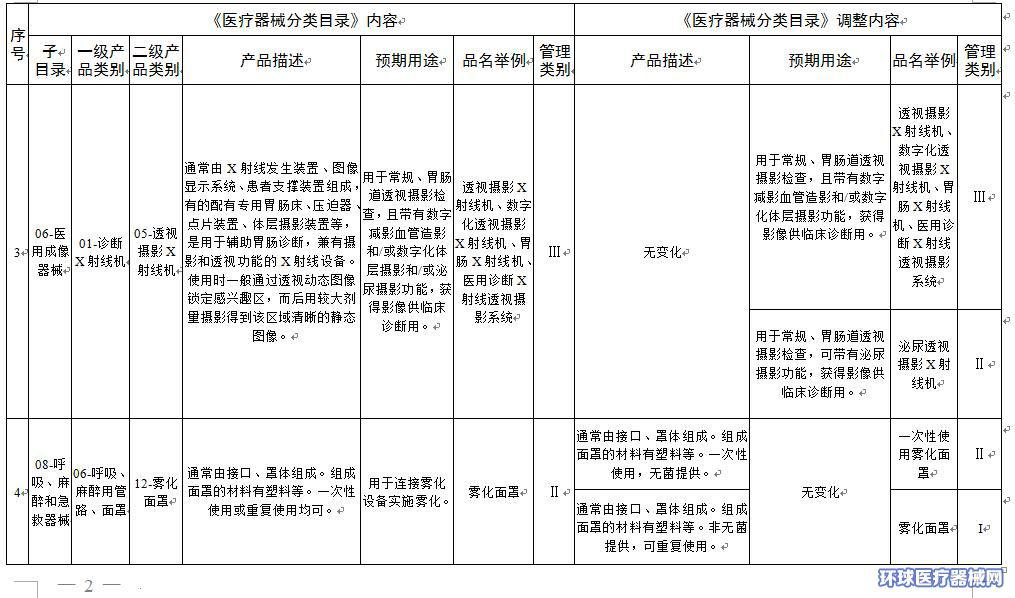
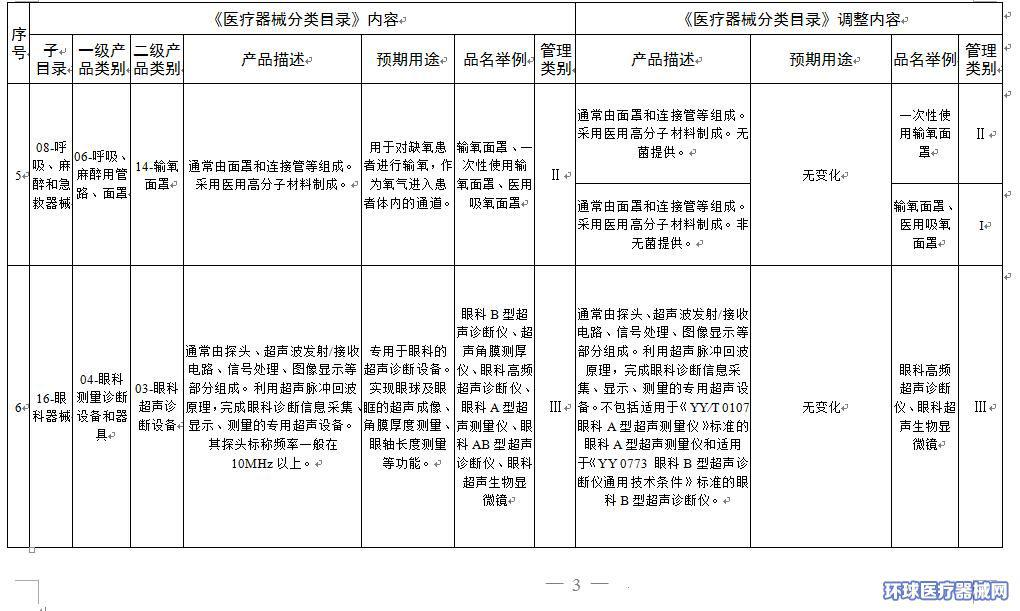
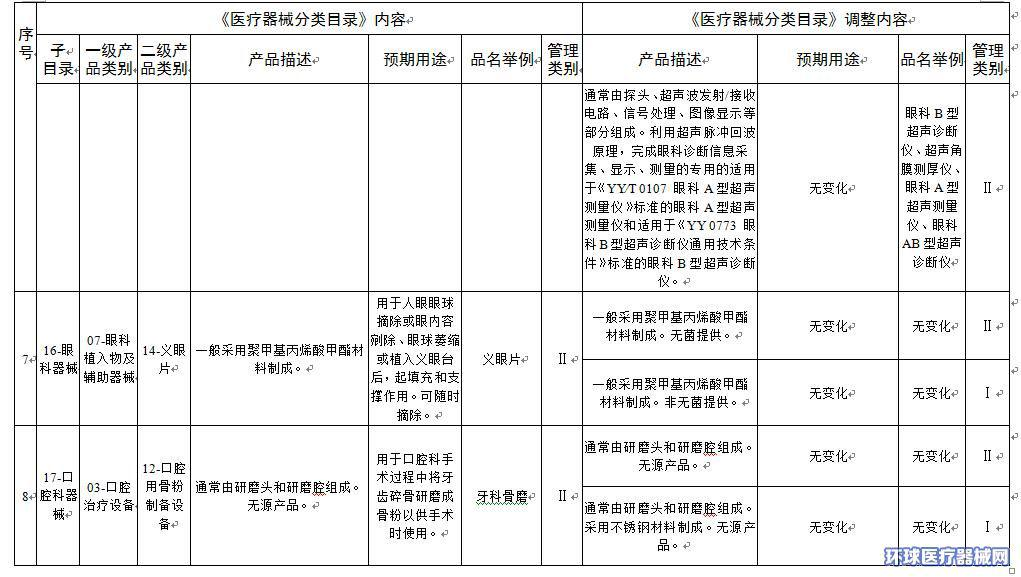
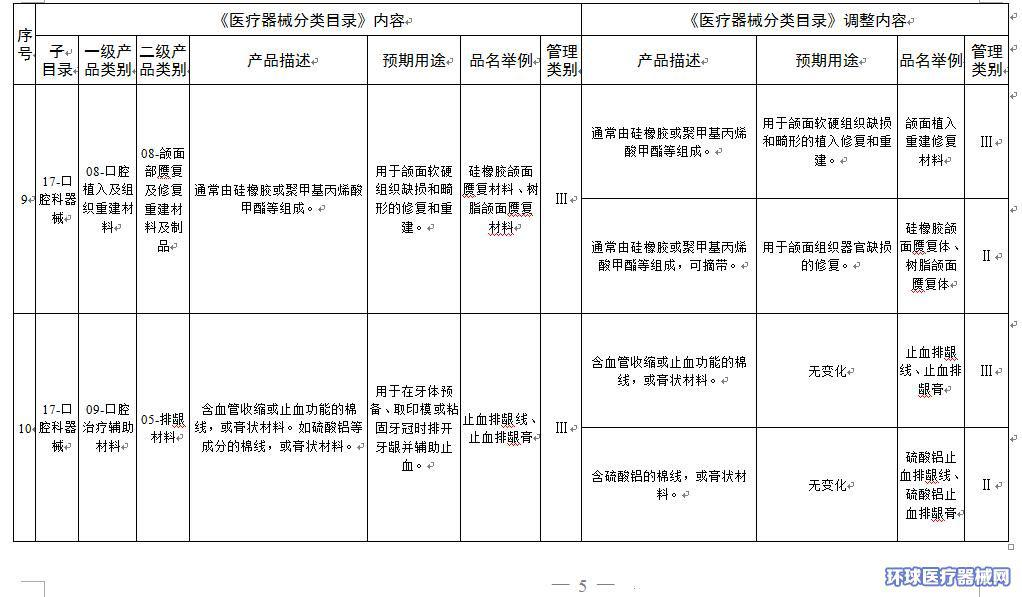
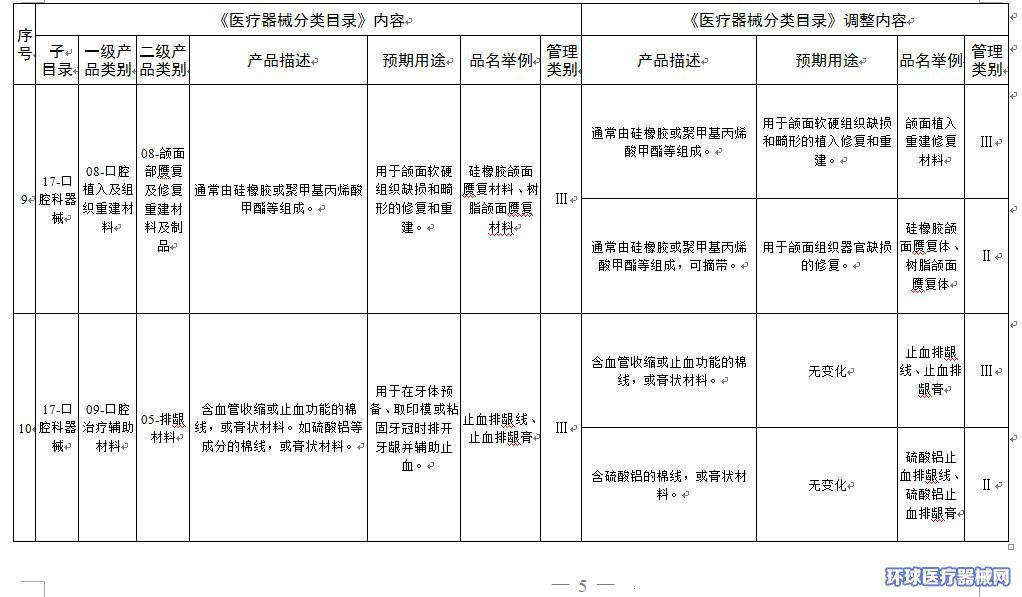
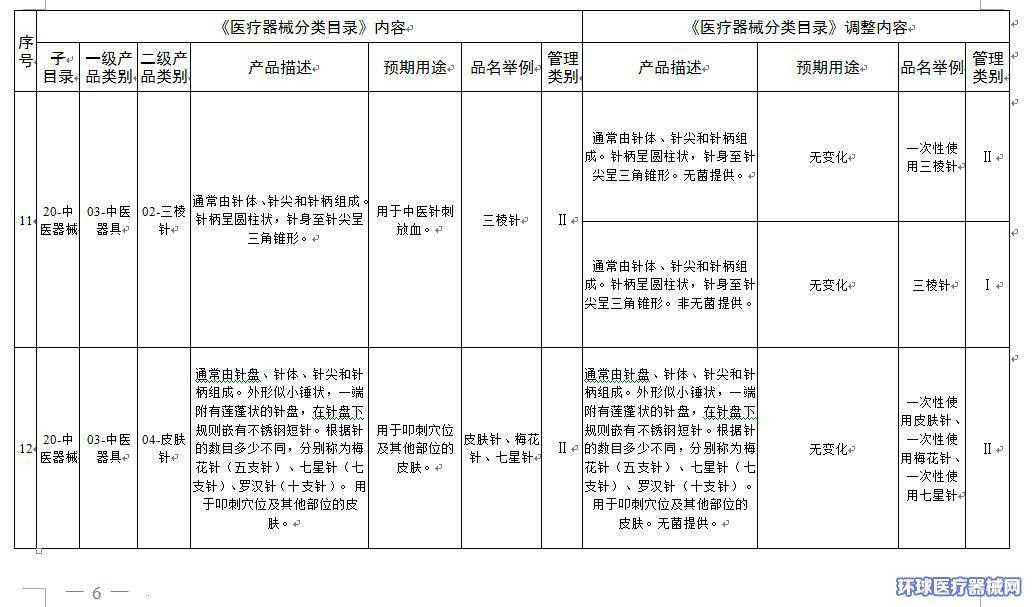
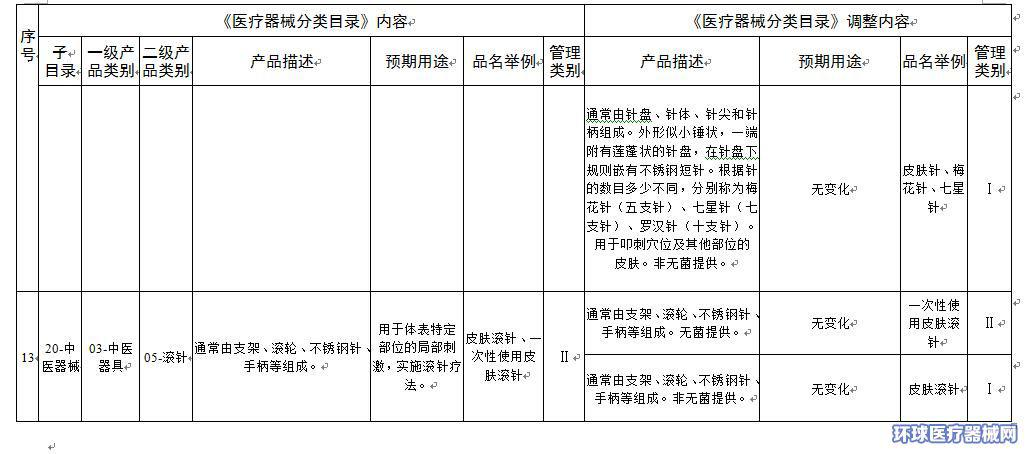
2.医疗器械分类目录内容调整意见汇总表
国家药监局
2020年12月18日
附件1
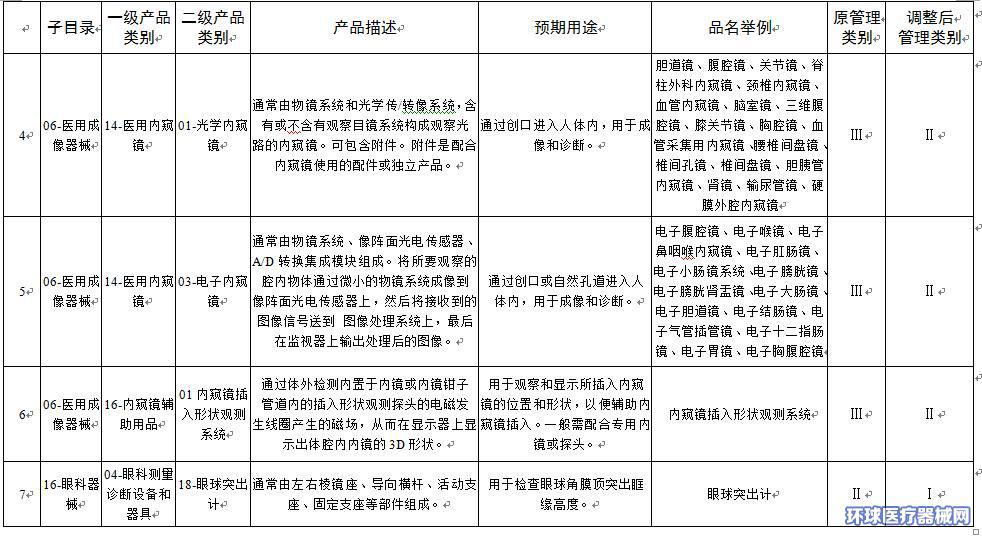 |
附件2


Copyright © 2022 杭州山友医疗器械有限公司 版权所有 备案号:浙ICP备05002935号-1 浙公网安备33010902001617号
《互联网药品信息服务备案凭证》编号:(浙)-非经营性-2024-0179
sitemap.xml 管理登陆 技术支持:化工仪器网